|
| Zurück |
Die Rolle der natürlichen Killerzellen (NK-Zellen)
in der Abwehr von Tumoren und der Nachweis der
NK-Zell-Aktivität zur Früherkennung maligner Tumoren
Innovationsforum
4. und 5. Oktober 2001, SenftenbergDas menschliche Immunsystem wird in ein humorales und ein zelluläres Immunsystem unterschieden. Die humoralen Immunreaktionen werden im Organismus durch die in B-Lymphozyten synthetisierten Antikörper abgesichert, die zelluläre (zellvermittelte) Immunreaktion ist die durch T-Lymphozyten bedingte Immunantwort. Die NK-Zellen gehören zum zellulären Abwehrsystem und sind ein Lymphozyten- Subset im Blut und in den lymphatischen Geweben. Es handelt sich um große lymphoide Zellen mit zahlreichen zytoplasmatischen Granula, die aufgrund ihrer Eigenschaften auch "large granular lymphozytes" (LGL) genannt werden. Grundsätzlich sind die verschiedenen Immunreaktionen immer aufeinander abgestimmt und werden vielfach durch das ZNS und durch verschiedene Bereiche des Hormonsystems moduliert. Funktion der NK-Zellen im System der Immun- bzw. Tumorabwehr
Argumentation: Wir wissen heute, dass das Immunsystem bei Tumorerkrankungen und insbes. in der Tumorabwehr wesentliche Funktionen besitzt. Dabei haben die NK-Zellen bei der Bekämpfung von sich entwickelnden Tumorzellen eine besondere Bedeutung. Es gibt sehr viele und zum Teil widersprüchliche Aussagen in den Publikationen über die Bedeutung der NK-Zellen bei Tumorerkrankungen, aber grundsätzlich gibt es Übereinstimmung über die herausragende Rolle der NK-Zellen in der Tumorabwehr. NK-Zellen besitzen die Fähigkeit, neoplastische und auch virusinfizierte Zellen zu erkennen und zu eliminieren. Das Abtöten durch NK-Zellen ist weder spezifisch für bestimmte Determinanten, noch ist es durch MHC-Moleküle (MHC = major histocompatibility complex) eingeschränkt. Ihnen fällt die Aufgabe zu, körpereigene Zellen von den Zellen zu trennen und zu eliminieren, die ihre MHC-Erkennungsstruktur verloren haben. Es handelt sich dabei um Tumor- oder virusveränderte Zellen. Die lytische Aktivität ist "natürlich", d. h. nicht durch ein spezifisches Antigen induziert, und daher eher Bestandteil der natürlichen Resistenz als der spezifischen Immunität. Die spezifische Reaktion zeigt sich besonders bei der Lyse virusinfizierter Zellen, denn nicht infizierte Zellen bleiben erhalten. Die NK-Zellen reagieren in einer sehr frühen Phase der Tumorentstehung, der Metastasierung, der Virusinfektion und bei Autoimmunerkrankungen. Sie werden durch Zytokine aktiviert, die u.a. von CD4* T-Lymphozyten gebildet werden. NK-Zellen sezernieren einige wichtige Zytokine, die wesentlich an der Regulation, Entwicklung und Durchsetzung der Immunantwort beteiligt sind. In der Folge übernehmen zytotoxische T-Lymphozyten (CTL) den Hauptanteil der Abwehr. Niedrige oder fehlende NK-Zellaktivität ist mit der Entstehung von Tumoren bzw. progredientem Tumorwachstum assoziiert. Es ist bekannt, dass niedrige NK-Aktivität zum Zeitpunkt der Diagnose prognostisch bedeutsam für den Erkrankungsverlauf mit früher Metastasierung ist.Diagnostik
Wie alle immunkompetenten Zellen tragen die NK-Zellen spezifische Oberflächenmarker, sog. "cluster of differentiation" (CD). Mit Hilfe der verschiedenen CD werden die Lymphozyten klassifiziert und identifiziert. Die NK-Zellen besitzen die Marker CD16* und CD56* und werden somit in der sog. Lymphozytendifferenzierung mit Hilfe der Durchflußzytometrie phänotypisiert. Überlappungen mit anderen Oberflächenmarkern sind möglich. Es kann in dem sog. Immunstatus resp. der Lymphozytendiff. nur eine Aussage über die Anzahl der NK- Zellen getroffen werden, die Aktivität der NK-Zellen bleibt unbekannt.
Zusammenfassung Neben der herkömmlichen Labordiagnostik und den Entwicklungen in den bildgebenden Verfahren zeigen uns die spezifischen immunologischen Labormethoden immer tiefere Einblicke in die Immunmechanismen des Organismus. Jedem interessierten Arzt stehen diese Labormethoden zur Verfügung. Neben der Bestimmung der NK-Zellzahl ist auch der Nachweis der NK-Zell-Aktivität in unserem Immunlabor möglich. Wir erhoffen uns neben den anderen immunologischen Testverfahren (z. B. Immunstatus, Tumormarker, OET) eine frühzeitige Erfassung des Funktionszustandes der NK-Zellen und der Initialphase des Tumorgeschehens resp. der Erfassung der Abwehrleistung bei einer Metastasierung. Mit diesem Test können wir eine wichtige Aussage bezüglich der bestehenden spezifischen Immunität bei Tumoren vornehmen und eine Aussage über den Einsatz immunmodulatorisch wirksamer Medikamente machen.
In der Diagnostik ist aber das Wissen über die Aktivität der NK-Zellen und deren jeweiligen Funktionsfähigkeit von außerordentlicher Wichtigkeit.
Neben der phänotypischen Charakterisierung durch die genannten Oberflächenmarker CD16 und CD56 ist eine routinemäßige Funktionsanalyse der NK-Zellen möglich. Es wird die Fähigkeit der patienteneigenen NK-Zellen (nach Isolierung aus dem peripheren Blut) eine NK-sensitive Leukämiezellinie (K562) abzutöten gemessen. Den Zellen der Zelllinie K562 fehlen MHC-Klasse I- und II-Antigene und sie sind außerordentlich sensitiv gegenüber NK-Zellen. Mit Hilfe der Durchflußzytometrie wird der Prozentsatz an Targetzellen, die durch die Aktivität der patienteneigenen NK-Zellen abgetötet worden sind, bestimmt.
Ein weiterer Test ist die Anwendung von radioaktiv markiertem Chrom 51 zur Charakterisierung der NK-Zell-Aktivität auf die o.g. Ziel- oder Targetzellen.Vorstellungen über die Wirkungsweise der NK-Zellen
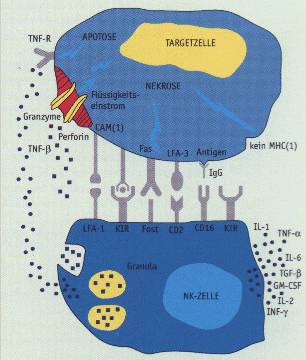
Die NK-Zell-vermittelte Zytotoxizität verläuft in mehreren Reaktionsschritten. Nach einer Identifizierung der Targetzelle durch spezielle Liganden (z. B. FAS) oder durch eine direkte Adhäsion an die Zielzelle kommt es zum höchsten Aktivierungsgrad der NK-Zelle. Es werden verschiedene Zytokine freigesetzt und an der Kontaktstelle der Zellen kommt es zur Ansammlung der Granula mit nachfolgendem Einstrom von Ca-Ionen. Jetzt wird das Zytokin Perforin freigesetzt (ein Protein von 65 kD), das die Zerstörung der Targetzelle mit Hilfe anderer Zytotoxine z. B. Granzyme und TNF-ß. einleitet. Gelingt es der Targetzelle die Strukturveränderungen abzufangen, dann erfolgt keine Zerstörung der Zielzelle.
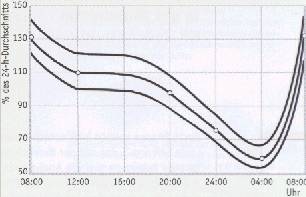
NK-Zellen sind als einzige Lymphozyten in der Lage, sowohl natürliche als auch antikörper-abhängige Zytotoxizität (ADCC) auszuführen. Diese Reaktion kann die natürliche Zytotoxizität übertreffen. Die ADCC wird besonders bei Virusinfektionen eingeleitet. Im peripheren Blut des Menschen befinden sich etwa 5 bis 15% der Lymphozyten als NK-Zellen, das sind etwa 30% der zytotoxischen Zellen überhaupt. NK-Zellzahl und NK-Aktivität korrespondieren über eine lange Zeit. Die NK-Zellzahl im peripheren Blut ist eine feste individuelle Größe mit z.T. erheblichen interindividuellen Abweichungen. Die Anzahl der NK-Zellen unterliegt einer erheblichen Tagesrhythmik (s. Abb.). Sie wird durch zahlreiche Faktoren wie körperliche Aktivität, Streßsituation, Infektionen und entzündliche Reaktionen beeinflußt. Nach Virusinfektionen kommt es innerhalb 24 Stunden zum schnellen Anstieg der NK-Zellzahl im Blut.Therapeutische Konsequenzen
Die konventionellen onkologischen Behandlungsverfahren, wie Chemotherapie, Chirurgie und Strahlentherapie haben nur bei wenigen Tumorerkrankungen echte Heilungserfolge gebracht. Die Nebenwirkungen und die Kosten dieser Standardmethoden sind teilweise erheblich. Viele onkologisch tätige Kollegen waren daher bemüht, auch therapeutisch neue Wege zu gehen. Ziel ist im allgemeinen die Steigerung der individuellen Abwehrleistung durch Immunmodulatoren wie Zytokine resp. Interleukine, Interferone, Mistellektine, exogene Peptide, Vitamine, Antioxydantien, Bakterienlysate. Durch eine gezielte Anwendung solcher Präparate, bei vorheriger Kontrolle des Immunsystems (mindestens Blutbild und Lymphozytendifferenzierung) kann die Aktivierung der zytotoxischen T-Zellen und der NK-Zellen erheblich beeinflußt werden. Bisher ist die Methode der "lymphokinaktivierten Killerzellen" (LAK-Zetten) am bekanntesten. Es werden aus dem Blut entnommene NK-Zellen mit IL-2 aktiviert und dem Patienten, reinfundiert. Der Erfolg dieser Methode hatte bisher noch nicht den erhofften Effekt. Es ist noch viel Forschungsarbeit zur direkten Immuntherapie eines Tumors erforderlich. Bisher können wir das Immunsystem, die körpereigene Abwehrleistung stärken bzw. aktivieren und unterstützen, können aber noch nicht die gezielte individuelle immunologische Tumortherapie durchführen.
Tagesrhythmik der NK-Zellen im peripheren Blut (nach Bieger)
Schematische Darstellung der NK-Zelle und ihre Interaktion mit einer Targetzelle (Zielzelle). Erkennung der Targetzelle über "killer cell inhibitory receptors" (KIR) oder durch MHC (I) bzw. durch aberrante Peptide. Adhesionsmoleküle verstärken den Kontakt zwischen NK-Zellen und Zielzellen und aktivieren die Zytolyse. Bestimmte Rezeptoren (CD16, spez. IgG) vermitteln die ADCC. Aktivierte NK-Zellen exprimieren Fas-Liganden (Fasi), der über die Bindung an Fas (CD95) auf der Targetzelle Apoptose induziert. Die NK- Zellen enthalten im Zytoplasma spez. Granula, die Perforin und Granzyme und werden zu "large granulär lymphocytes" (LGL). Nach Bindung an die Zielzelle wandern die Granula zur Bindungszone und fusionieren mit der Zellmembran und setzen den Inhalt frei. Perforin bildet unter Ca2+_ Einfluss Polymere, die sich zu Poren in der Zellmembran der Targetzelle formieren. Durch diese strömen Flüssigkeit (Schwellung, Nekrose) und Granzyme ein. Die aktivierte NK-Zelle sezerniert weiterhin eine Vielzahl effektorischer (γ-IFN, α-TNF, ß-TNF) und regulatorischer (IL-6, IL-1, IL- 2, GM-CSF, TGF-...) Zytokine. (nach Bieger, verändert)